Jiraporn Srisalaa, Piyachat Saguanruta, Suparat Taengchaiyaphuma, Rapeepun Vanichviriyakitb, Kallaya Sritunyalucksanaa, Timothy W. Flegelb,c
aAquatic Animal Health Research Team, Nhóm Tích hợp Nghiên cứu Công nghệ Sinh học Nuôi trồng Thủy sản, Trung tâm Kỹ thuật Di truyền và Công nghệ Sinh học Quốc gia (BIOTEC),
Cơ quan Phát triển Khoa học và Công nghệ Quốc Gia (NSTDA), Cơ sở Yothi,
Rama VI Rd., Bangkok 10400, Thái Lan
bTrung tâm Chuyên sâu cho Sinh học Phân tử Tôm và Công nghệ Sinh học (Tôm Centex),
Khoa Khoa học, Đại học Mahidol, Rama VI Rd., Bangkok 10400, Thái Lan
cNational Centre for Genetic Engineering and Biotechnology (BIOTEC), Cơ quan phát triển Quốc gia về Khoa học và Công nghệ (NSTDA), Công viên Khoa học Thái Lan, Khlong Luang,
Pathum Thani, Thái Lan 12120
Đặc điểm của thể vùi WZV8
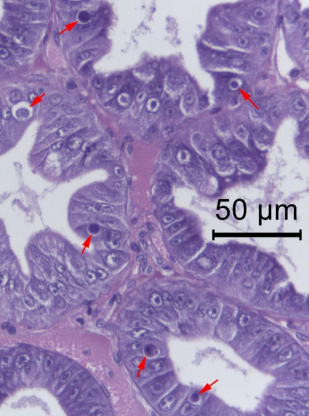
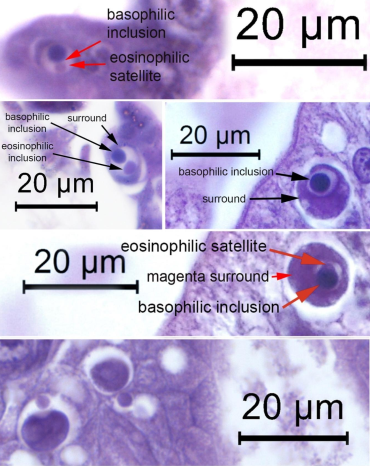
Bằng cách nhuộm hematoxylin và eosin (H&E), thể vùi WZV8 ái kiềm cao có mặt cắt hình tròn và được chứa trong không bào của tế bào chất (Hình 1, 2). Không nên nhầm lẫn chúng với các tấm phân bào (Hình 3) thường thấy trong các tế bào phôi là những nơi có tốc độ phân bào cao. Mặc dù các thể vùi ái kiềm dạng tròn là chiếm đa số, vẫn có những biến thể về hình dạng của chúng. Ví dụ, chúng đôi khi liên kết với những thể vùi ái toan dạng tròn gần đây hoặc kế bên, chúng thường có kích thước nhỏ hơn (Hình 4). Đôi khi các thể vùi tương tự cũng được nhìn thấy trong biểu mô ống hệ gan tuỵ đã biệt hóa tế bào và một ví dụ của hình ảnh hiển vi về thể vùi WZV8 trong tế bào R được minh họa trong Hình 5. Ngoài ra, các thể vùi kép đôi khi được ngăn cách bởi một khoảng trống từ một lớp màng “bao quanh” từ có màu đến đỏ tươi với độ dày thay đổi cũng là ngăn cách với tế bào chất của tế bào chủ bởi một khoảng trống.
Các bộ thể vùi kép bao gồm một thể vùi ái kiềm và một thể vùi ái toan có thể phổ biến nhưng phần thể vùi ái toan chủ yếu là nhỏ so với phần ái kiềm lớn hơn, điều này khiến cho xác suất nhỏ bé để chúng xuất hiện cùng nhau trong các lát cắt mô 4 micron. Do đó, rất khó để xác định liệu sự kết đôi đặc thù này diễn ra thường xuyên hay chỉ chiếm xác suất thấp. Cần thêm nhiều nghiên cứu để xác định mối quan hệ giữa các thể vùi này và cách chúng phát triển. Chúng tôi hy vọng rằng phương pháp dùng kính hiển vi điện tử truyền qua (TEM) sẽ giúp đạt được mục tiêu này.
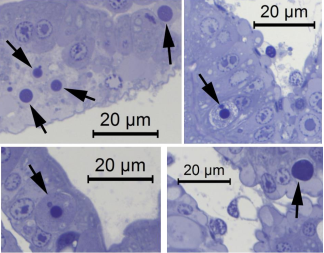
Hình ảnh hiển vi các lát cắt bán mỏng của thể vùi WZV8 trong tế bào phôi cũng được hiển thị trong Hình 6, đã nhuộm màu xanh lam toluidine. Các tế bào thể vùi kép rất đặc biệt về bản chất của chúng bởi cả nhuộm H&E và trong các lát cắt bán mỏng của chúng đến nỗi sự hiện hiện của thể vùi cùng với các vị trí phổ biến trong tế bào phôi có thể được coi là đặc điểm bệnh lý đối với nhiễm WZV8. Chúng tôi đề xuất gọi những loại thể vùi đặc hữu này là “Thể vùi kép nhẹ hơn” (LDI) để tôn vinh Giáo sư Donald V. Lightner – người đã qua đời gần đây, cũng là người mà chúng tôi rất biết ơn về công trình đồ sộ của ông đã đóng góp trong lĩnh vực bệnh lý tôm.
Ban đầu chúng tôi suy đoán rằng những thể vùi này có thể là giai đoạn phát triển của Microsporidian Enterocytozoon hepatopenaei (EHP), nhưng sau đó chúng được phát hiện là âm tính với EHP bằng cách sử dụng một probe lai tại chỗ (ISH) cụ thể. Ngoài ra, chúng tôi đã nghiên cứu bằng phân tích mô học và xét nghiệm ISH rằng EHP không lây nhiễm sang tế bào phôi (Flegel, Năm 2012; Chaijarasphong và cộng sự, 2020).
Sau khi phát hiện và báo cáo trình tự bộ gen WZV8 (số truy cập Ngân hàng gen KX883984.1) là một loại virus mới thuộc bộ Picornavirales, chúng tôi đã có thể thiết kế primer PCR và probe lai tại chỗ để phát hiện nó. Các xét nghiệm ISH tiếp theo với RT-PCR của tôm dương tính với các mẫu WZV8 cho phép chúng tôi xác định các thể vùi được mô tả ở đây như được liên kết với WZV8. Một đánh giá các mẫu slide mô đã lưu trữ của chúng tôi tiết lộ những thể vùi WZV8 trong những mẫu tôm bình thường từ vô số các trại tôm trong vùng Châu Á-Đại Tây Dương sớm nhất vào năm 2008. Gần đây hơn, chúng tôi đã quan sát được thể vùi ở giống tôm thẻ chân trắng từ hai quốc gia ở Châu Mỹ.



Phát hiện RT-PCR ở WZV8
Chúng tôi cũng cung cấp ở đây chi tiết về phương pháp phát hiện RT-PCR lồng nhau cho WZV8 dựa trên trình tự ban đầu từ Li et. al (2015) (Bản ghi GenBank KX883984.1). Ấn phẩm phát hành gần đây hơn từ Trung Quốc (Liu et al. 2021) cũng cung cấp đầy đủ chuỗi PvPV dựa vào bản ghi GenBank OK662577. Mồi thuận và mồi ngược cho RT-PCR đầu tiên và các mẫu PCR nối tiếp được thiết kế từ gen RNA polymerase phụ thuộc RNA (RdRp) giả định của Bản ghi GenBank KX883984.1. Điều này đã được thực hiện trước khi phát hành chuỗi PvPV tại GenBank vào năm 2022. Chúng tôi đã sử dụng thành công phương pháp RT-PCR này để sàng lọc tôm qua các mẫu RNA từ các khách hàng toàn cầu. Chúng tôi sẵn sàng cung cấp (miễn phí) plasmid chứa mục tiêu của phương pháp PCR này cho bất kỳ ai yêu cầu. Điều này sẽ được cung cấp dưới dạng plasmid khô trên giấy lọc sẽ được gửi bằng đường hàng không thông thường và có thể được rửa giải để biến đổi E.coli. Điều này sẽ cung cấp nguồn plasmid vĩnh viễn để sử dụng làm đối chứng dương tính trong các xét nghiệm RT PCR và làm mục tiêu để tạo ra một đầu dò DNA cụ thể WZV8 cho ISH bằng PCR. Trình tự đoạn mồi được thể hiện trong Bảng 1.

Như được thể hiện trong Hình 7, Outer Foward Primer cho bước đầu tiên của phương pháp RT-PCR này có một đoạn mồi không khớp ở base cuối cùng khi phù hợp với bản ghi PvPV của GenBank, trong khi Inner Foward có 3 điểm không khớp. Do đó, phương pháp RT-PCR này và liệu trình kiểm soát plasmid chỉ có thể được coi là một phương pháp khẩn cấp tạm thời cần được sửa đổi khi các chuỗi đầy đủ của nhiều phân lập WZV8 tích tụ và được sắp xếp để tìm kiếm trình tự mục tiêu phổ quát.
Phản ứng RT-PCR bước đầu tiên được thực hiện trong 12,5 µl hỗn hợp bao gồm 1X Phản ứng Trộn (Invitrogen, Hoa Kỳ), 0,4 µM mỗi đoạn mồi 482F và 482R, 0,5 µl SuperScript III RT/Platinum Taq Mix (Invitrogen, Hoa Kỳ) và 100 ng khuôn mẫu RNA. Giao thức RT-PCR bắt đầu với 50°C trong 30 phút, sau đó là 94°C trong 2 phút và sau đó là 35 chu kỳ 94°C trong 30 giây, 60°C trong 30 giây và 68°C trong 45 giây cộng với thời gian kéo dài cuối cùng ở 68°C trong 5 phút.
Đối với bước PCR lồng nhau, hỗn hợp 12,5 µl chứa 1X OneTaq Hot Start Master Mix (NEB, Hoa Kỳ), 0,2 µM của mỗi đoạn mồi 168F và 168R, và l µl dung dịch sản phẩm từ bước RT-PCR đầu tiên. Giao thức PCR lồng nhau là 94°C trong 5 phút, sau đó là 25 chu kỳ 94ºC trong 30 giây, 60ºC trong 30 giây và 72ºC trong 30 giây cộng với phần mở rộng cuối cùng trong 5 phút ở 72ºC. Các amplicon thu được lần lượt là 482 bp và 168 bp.
Chỉ đưa ra 1 base không phù hợp ở đầu 3’ của đoạn mồi trước-ngoài với sự phù hợp vùng của bộ gen PvPV và không khớp với mồi ngược-ngoài, có khả năng là phương pháp này có thể được sửa đổi một chút như một phương pháp RT-PCR tạm thời bán lồng nhau bằng cách sử dụng chiết xuất RNA từ tôm nhiễm PvPV. Cụ thể, bước RT-PCR đầu tiên sẽ sử dụng giao thức tương tự như được mô tả ở trên với một sản phẩm cũng là 482 bp. Tuy nhiên, ở bước PCR thứ 2, cùng lớp mồi trước-ngoài như trong RT-PCR bước đầu tiên sẽ được sử dụng để thay đoạn mồi Trước-trong cùng với đoạn mồi ngược-trong (không khớp). Đây sẽ cho sản phẩm PCR dài hơn 9 bp đối với WZV8 trong Bảng 1 (tức là 177 bp thay vì 168). Điều này là do trình tự chuyển tiếp của mẫu từ phản ứng bước đầu tiên đã thay thế mục tiêu PvPV ban đầu trong khi mồi ngược giống với mục tiêu trong chuỗi PvPV ban đầu.
So sánh trình tự amplicon
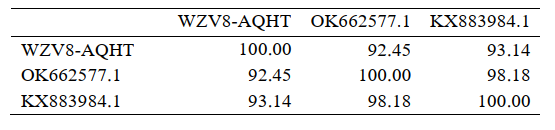
Sự liên kết Clustal Omega của các trình tự đồng thuận của amplicon RT-PCR từ mẫu hiện tại (WZV8-AQHT, xuất xứ không được chỉ định) và loại trừ trình tự mồi. Phần trăm nhận dạng giữa ba trình tự RdRp là có ý nghĩa (Bảng 2), ngay cả đối với hai chuỗi GenBank từ Trung Quốc. Điều này cho thấy sự thay đổi tương đối cao trong các loại hiện có có thể khác nhau về độc lực đối với tôm. Với tư cách là nhà nghiên cứu bệnh học tôm, chúng tôi mong muốn thông tin này được phân phối rộng rãi và nhanh nhất có thể để khuyến khích hợp tác và trao đổi thông tin về virus giống WZV8.
Ngọc Thạch (Lược dịch)











